作者简介:汤鹏(1957-),男,广东梅县人,海南省人民医院乳腺外科主任,主任医师,从事肿瘤外科学研究。
患者, 女性, 40岁。2008年6月10日体检发现左腋下多发肿块。肿块质地中等, 边界尚清, 活动度好, 最大径3.5 cm。门诊彩超示右侧乳腺及左侧腋窝实性肿块。钼靶提示双侧乳腺增生症。考虑为乳腺癌并左腋窝淋巴结转移癌。为进一步明确诊断和治疗而住院。发病以来食欲、睡眠好, 大小便正常。
既往无高血压、糖尿病史, 无肝炎、结核病史; 3年前曾行“ 结节性甲状腺肿” 手术; 无外伤史; 否认输血史, 无吸烟、酗酒史; 无药物过敏史。已婚15年, 月经1240岁; 无肿瘤家族史。
专科体查:双乳对称, 皮肤无“ 橘皮” 样改变, 双侧乳头等同水平, 无乳头内陷及偏移。双侧乳腺可扪及片状增厚乳腺组织, 有结节感、质韧、无压痛。左腋下扪及多发肿大淋巴结, 最大径3.5 cm, 质地中等, 边界清, 活动度好, 无压痛。
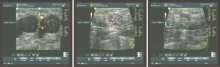
彩超提示右侧乳腺及左侧腋窝实性肿块(见图1)。钼靶提示双侧乳腺增生症。胸部CT未见异常。实验室检查血常规、生化、肿瘤标志物未见异常。穿刺活检病理:淋巴结转移性低分化癌。
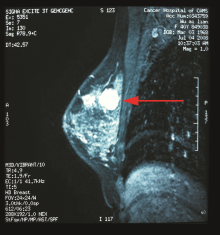
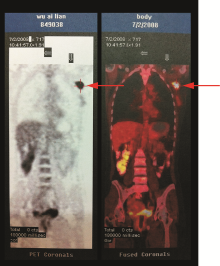
20天后病人转到北京某医院进行进一步的诊治, 检查项目和结果如下:乳腺MRI提示右乳结节, 乳癌?双乳增生结节; 左腋下淋巴结转移癌(见图2)。PET-CT提示左腋下淋巴结转移癌; 右乳肿物腺体增生与肿瘤鉴别(见图3)。再次穿刺活检:左乳多发结节, 增生导管上皮细胞; 左腋下为分化差的癌, 符合腺癌, 右乳为纤维瘤。
2008-07-05全麻下行左腋窝淋巴结清扫术+右乳肿块切除术。术后病理:淋巴结转移性低分化腺癌2/10(形态考虑乳腺来源)。免疫组化:CK7 (+++)、CK18(++)、C-erBb2(+++)、ER(-)、PR(-)。右乳肿物:囊性增生+局灶叶状肿瘤形成。
术后当地医院的初始化疗方案为EPI+PTX(4周期), 治疗后出现乳腺皮肤红肿、“ 橘皮” 样改变, CA125进行性升高。后更改治疗方案为:NVB+Xeloda (6周期)+曲妥珠单抗 1年。治疗过程中, 皮肤红肿消退, “ 橘皮” 样改变消失, CA125进行性下降。并在全麻下行左侧全乳切除术。术后病理提示:(左)乳腺组织中未见癌残留, 乳头和基底切缘干净。
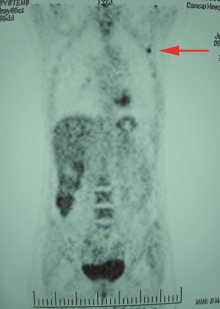
2010年5月彩超示:左腋窝、左锁骨上淋巴结肿大。PET-CT(北京肿瘤医院)示:左腋窝、左锁骨上淋巴结肿大, 伴代谢高, 考虑转移(图4)。2010年6月, 于该院行左腋窝淋巴结清扫术。术后病理提示淋巴结转移性腺癌4/4。2010年7月予以补充放疗:腋窝+锁骨上区。放疗后进行化疗:吉西他滨+顺铂+曲妥珠单抗。
问题1:对于缺乏原发灶证据的腋窝转移癌, 如何完善术前检查?
谢贤和(海南省人民医院主任医师):病人为40岁的中年女性, 左腋下多发肿块, 开始在当地医院穿刺活检病理诊断是(左腋下)淋巴结转移性低分化癌, 应做较全面的检查以确定原发肿瘤的来源。例如乳腺MRI、骨扫描、上腹部及妇科彩超等。
吴煌福(海南省农垦总局医院主任医师):病人住院检查存在缺陷, 左腋下多发淋巴结肿大, 最大已达3.5 cm。如此大的肿块, 在钼靶、胸部CT却未能显示。正如谢主任所言, 应做较全面的检查。同时可以考虑PET-CT检查。确定是否存在远处转移, 或排除其他器官的原发灶。
郑武平(海南医学院第一附属医院主任医师):术前应该明确右侧乳腺肿物的性质, 同意再次穿刺的方案。
旁述:乳腺癌临床实践指南(中国版)指出:对于腋窝淋巴结转移癌, 源于多个依据需做MRI、CT、PET/CT、穿刺活检等。对缺乏原发灶证据的(腋窝转移)腺癌, 需行胸腹CT检测是否存在远处转移, 以及乳腺MRI、超声检查。PET/CT联合常规的分期检查方法还能够协助判断局部晚期乳腺癌病例中未被怀疑的区域是否有淋巴结转移或远处转移。对于转移性疾病, 专家组认为对可疑部位的活检更可能提供有用信息[1]。
问题2:临床诊断及分期?
刘安(海口市妇幼保健院主任医师):患者已做全面的检查, 包括了钼靶、乳腺MRI、胸部CT、腹部B超、PET/CT, 均未发现其他部位存在原发病灶的可能。再次穿刺的病理仍为分化差的腺癌, 临床上可诊断为左侧隐匿性乳腺癌。
王若天(琼海市人民医院肿瘤外科主任医师):患者左腋下多发、散在淋巴结, 并未融合成团, 为N1, 乳腺并无原发灶, T0。故临床分期为:T0N1M0[1]。
袁素(海南省人民医院病理科副主任医师):乳腺癌的转移虽与肺癌、胃肠道肿瘤的转移相似, 但免疫组化可鉴别。临床上中年以上妇女, 腋窝可扪及肿块而全身其余器官未发现异常者, 应考虑行腋窝肿块针吸细胞学和切除活检, 并行免疫组化测定ER、PR。这是确诊隐匿性乳腺癌的重要手段[2]。近年来, 表皮生长因子受体2(HER2/neu)及抗人乳腺癌特异糖蛋白单克隆抗体(M4G3)的检测正在推广应用[3]。牛昀等[2]报道, M4G3在隐匿性乳腺癌的检出率为93.55%(58/62), 与免疫组化相结合, 可以明确原发灶来源[4]。
问题3:完善检查后的治疗方案选择?
吴煌福:按照病人的临床分期T0N1M0, 我建议按指南的原则选择先手术、后进行其他辅助治疗。手术方式:左腋窝清扫+左乳腺全切术。再根据术后病理、淋巴结状态、免疫组化结果, 制定辅助治疗方案。
郑武平:同意先手术、后进行辅助治疗。但由于左乳腺未发现原发灶, 手术方式上我认为应更慎重些, 可考虑左腋窝清扫+全乳加或不加淋巴结放疗。
钟晓捷(海南省人民医院乳腺外科主任医师):该患者手术后的病理切片并未见癌残留。这使我们想起对于隐匿性原发乳腺癌的治疗, 还存在一种“ 观察等待” 的观点:“ 对于隐匿性乳腺癌, 其原发灶可能有5年以上的潜伏期, 也有人采用观察等待法, 如此外科大夫不必担心因切除‘ 正常乳房’ 引起的麻烦(70%术后病理明确)。但多数外科大夫不认同这种方法, 应与病人及家属共同讨论, 找出双方认可的积极治疗方案” [5]。由此可见, 隐匿性乳腺癌如需乳腺切除, 要十分慎重, 术前的充分沟通是非常必要的。毕竟有30%的患者术后病理仍然不能找到原发灶[6]。
旁述:NCCN隐匿性原发乳腺癌指南指出, MRI结果阴性的患者推荐基于淋巴结状况进行治疗。对于T0N1M0的患者, 可选的治疗方法包括乳腺切除+腋窝淋巴结清扫。或腋窝淋巴结清扫+全乳放疗联合或不联合淋巴结放疗(辅助治疗按Ⅱ 、Ⅲ 期)。对于T0N2-3M0的患者, 按局部晚期治疗[1]。
问题4:如何看待术后首次化疗后的乳腺皮肤红肿, “ 橘皮” 样改变?
谢贤和: 2010版指南提出, 术后辅助治疗应先化疗后放疗。化疗方案应选择蒽环+紫杉类药物。免疫组化C-erBb2(+++), 应加靶向治疗。最好是AC→ TH方案。从病例回顾看, EPI+PTX 4周期, 疾病出现进展而更改化疗方案, 加用曲妥珠单抗之后, 病情控制。可见第一次的方案选择可能存在缺陷。
刘安:按照指南, 术后辅助治疗遵循先化疗后放疗的顺序, HER-2阳性者, 如经济条件许可, 应尽早加用曲妥珠单抗靶向治疗。文献报道, HER-2阳性未用曲妥珠单抗者, 中位生存期仅3年, 而使用后中位生存期达6~7年。其最佳使用时间应为1 年[7]。
李发奋(海南省人民医院放疗科主任医师):
同意先化疗后放疗, 放疗范围包括全乳+锁骨上区。
旁述:乳腺癌临床实践指南指出, 如有化疗指征, 放疗应在化疗后进行[1]。
中国HER-2阳性乳腺癌诊疗专家共识:曲妥珠单抗用于HER-2阳性早期乳腺癌术后辅助治疗, 可明显降低患者的复发率和死亡率。HER-2阳性乳腺癌曲妥珠单抗辅助治疗用药推荐AC-TH、TCH、标准化疗后单用。目前认为, HER-2阳性乳腺癌采用曲妥珠单抗辅助治疗, 合适的用药周期为1年。FinHer研究最新随访结果并没有证明9周曲妥珠单抗治疗能改善患者预后。至今尚无证据表明曲妥珠单抗2年辅助治疗的效果更好[7]。
问题5:有关术后复发的治疗方案选择?
李发奋:病人治疗时间已有2年, 经全面检查, 病灶仍然局限在腋窝及锁骨上。所以尽管指南指出术后的辅助治疗应先化疗后放疗, 但我还是认为此患者的病灶一直以局部为主, 先局部控制(放疗), 再全身(化疗等)治疗应该是较好的选择。
谢贤和:HER-2阳性乳腺癌诊疗中国专家共识指出, HER-2阳性患者, 出现复发、转移时, 可在继续应用曲妥珠单抗的基础上, 更改化疗方案。赞同患者出现复发、转移时, 继续以曲妥珠单抗为基础, 联合吉西他滨+顺铂的化疗方案[7]。
郑武平:同意个体化治疗, 先化疗后放疗。但该病例没有显示转移灶的病理情况。对于转移性疾病, 认为对可疑部位的活检更可能提供有用信息。建议对转移灶蜡块重新进行检测[3]。
汤鹏(海南省人民医院主任医师):综合各位专家的讨论意见, 对于隐匿性原发乳腺癌的诊治, 可作如下总结:腋窝淋巴结肿大、疑似隐匿性乳腺癌的患者, 进一步的检查包括B超、MRI、CT、PET/CT、病理(穿刺或切除)、转移灶雌激素受体状态等。原发灶明确者, 按肿瘤临床分期相应治疗。原发灶未明者推荐基于淋巴结状况进行治疗:对于T0N1M0的患者, 可选乳腺切除+腋窝淋巴结清扫; 或腋窝淋巴结清扫+全乳放疗联合或不联合淋巴结放疗(乳腺切除者术前应充分沟通)。辅助治疗按Ⅱ 、Ⅲ 期相应治疗[8]。对于T0N2-3M0的患者, 按局部晚期治疗[9]。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|