作者简介:
 | 王群,主任医师,教授,复旦大学附属中山医院胸外科主任。中华医学会胸心血管外科学分会委员兼胸腔镜学组副组长、中国医师协会胸外科分会常务委员(上海工作部副主任、微创学组副主席)、中国抗癌协会食管癌专业委员会常务委员、中国抗癌协会肺癌专业委员会常务委员、英国皇家外科学院Fellow(FRCS,Fellow of Royal College of Surgeons)、卫生健康委员会临床路径专家委员会胸外科专家组组员、卫生健康委员会内镜专业技术考评委员会胸心外科分会常务委员、上海市医学会胸外科专科分会副主任委员、上海市抗癌协会胸部肿瘤专业委员会副主任委员。担任《ATS》中文版、《中华胸心血管外科》、《中华胃肠外科杂志》、《中国胸心血管外科临床》、《上海医学杂志》及《Journal of Thoracic Disease》等杂志编委。 精通普胸外科各种常见疾病以及罕见病的诊治,对各类胸外科常规手术及复杂手术有着丰富的临床经验,尤其对肺癌、食管癌等疾病有较高的造诣,提倡肺癌、食管癌的规范化治疗,特别注重对肺癌、食管癌手术中淋巴结清扫的彻底性。擅长VATS肺叶切除术、肺段切除术等各类微创手术。 近五年在国内外学术杂志发表论文30余篇,其中SCI论文10余篇。 |
Vansteenkiste JF, Cho BC, Vanakesa T, et al.Efficacy of the MAGE-A3 cancer immunotherapeutic as adjuvant therapy in patients with resected MAGE-A3-positive non-small-cell lung cancer (MAGRIT): A randomised, double-blind, placebo-controlled, phase 3 trial [J]. Lancet Oncol, 2016, 17(6):822-835.
1b。
• 在完全切除的非小细胞肺癌(non-small cell lung cancer, NSCLC)患者中, 只有不到一半的患者被治愈, 而其他患者的癌症复发通常是致命的。在过去的几十年里, 已研究了几种辅助治疗方法来改善这些患者的预后。
• 目前发现MAGE-A3是肿瘤组织表达最多的肿瘤-睾丸抗原(cancer-testis antigen, CTA)之一, 被认为是真正的肿瘤特异性抗原, 在许多肿瘤中表达, 例如恶性黑色素瘤、肺癌、头颈部肿瘤、肝细胞癌等。30%~50%的NSCLC存在MAGE-A3表达, 其中鳞癌(48%)比非鳞癌(24%)比例更高。而对于可切除的NSCLC, 只有不到一半的患者达到临床治愈, 更多的患者会出现肿瘤复发。传统的辅助化疗无法提供更多的临床获益, 针对MAGE-A3抗原的肺癌疫苗对术后患者体内残存的癌细胞可能具有一定的治疗潜力。
评估MAGE-A3免疫治疗对NSCLC患者术后辅助治疗的疗效。
• 研究条件:欧洲、美洲和亚太地区34 个国家443个中心参加的MAGRIT临床研究(NCT00480025)。
• 研究时间:2007-10-18至2012-07-17。
• 研究方法:多中心、随机、双盲、安慰剂对照Ⅲ 期临床试验。
• 研究对象:完全切除原发灶的Ⅰ B~Ⅲ A 期 MAGE-A3阳性的NSCLC, 不论是否曾接受过辅助化疗。
• 干预措施:入组患者按2:1比例随机分配到MAGE-A3组(1 515例)和安慰剂组(757例), 40例患者经过随机分组但未接受任何治疗, 见图1。MAGE-A3组的免疫疗法包含重组MAGE-A3抗原肽+AS15免疫增强剂。
• 评价指标:总体人群的无病生存期(disease-free survival, DFS); 未化疗人群的DFS; 具有潜在预测基因特征的患者, 包括总治疗人群(所有接受过至少一次治疗剂量的患者)。
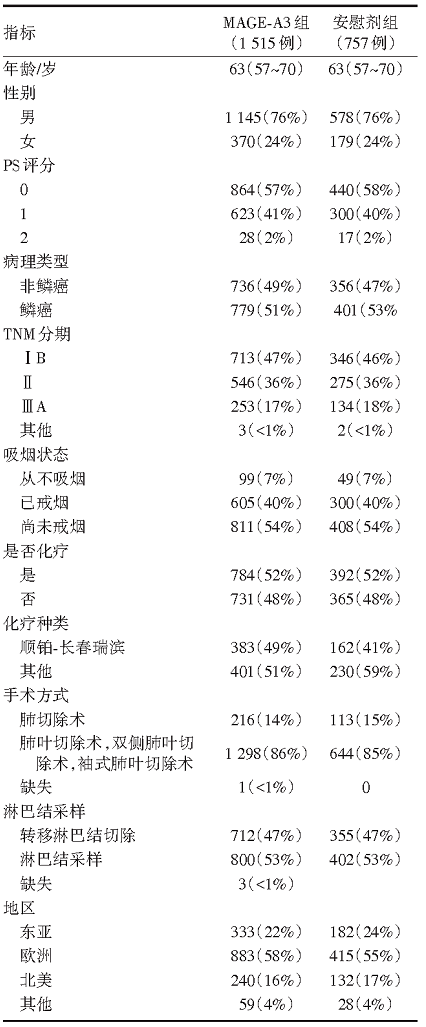
2007-10-18至2012-07-17, 从13 849例患者中筛选出了12 820例有标本的患者, 其中4 210例(33%)罹患MAGE-A3阳性肿瘤。2 312例符合纳入标准。经随机分组后, 1 515例接受MAGE-A3治疗, 757例接受安慰剂治疗, 还有40例被分组但从未接受治疗。MAGE-A3组和安慰剂组中分别有784例及392例患者同时接受了化疗。两组患者的基线特征见表1。
| 表1 MAGRIT研究中患者的基线水平及疾病特征 |
MAGE-A3组和安慰剂组的中位随访期分别为38.1个月(四分位间距为27.9~48.4个月)及39.5个月(四分位间距为27.9~50.4个月)。
在总人群中, MAGE-A3组患者的中位DFS为60.5个月[95%可信区间(confidence interval, CI)57.2个月至未达到], 安慰剂组为57.9个月(95%CI 55.7个月至未达到), 风险比为1.02(95%CI 0.89~1.18, P=0.74)。
在未接受化疗的人群中, MAGE-A3组患者的中位DFS为58.0个月(95%CI 56.6个月至未达到), 安慰剂组为56.9个月(95%CI 44.4个月至未达到), 风险比为0.97(95%CI 0.80~1.18, P=0.76)。由于并无显著疗效, 因此并未识别出提示MAGE-A3疗法临床获益的预测基因。
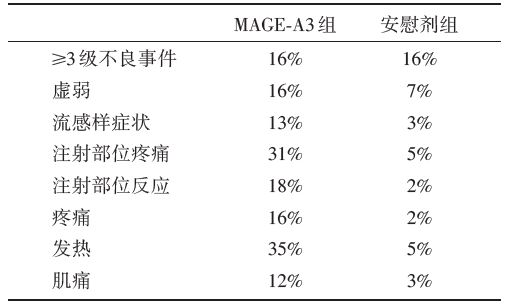
试验组和安慰剂组间≥ 3级不良事件发生率相近(均为16%), 见表2。试验组和安慰剂组中报告最多的≥ 3级不良事件为感染(2% vs. 3%)、血管疾病(2% vs. 3%)以及肿瘤事件(2% vs. 2%)。
| 表2 MAGRIT研究中患者的毒副反应 |
两组的中位DFS分别为58个月和56.9个月。两组患者中约有16%的病例发生≥ 3级不良事件, 无显著组间差异。
免疫治疗用于肿瘤治疗正受到越来越多的关注。目前已经获得成功的免疫治疗主要有免疫检查点(Checkpoint)抑制剂和嵌合抗原受体T细胞免疫疗法(CAR-T)。免疫治疗最早在血液系统肿瘤和黑色素瘤的治疗中获得成功, 近年来在实体肿瘤中也逐渐获得成功。免疫检查点抑制剂PD-1/PD-L1抗体和CTLA4抗体已获得FDA批准上市, 但主要用于晚期肺癌。免疫检查点抑制剂用于肺癌术后辅助治疗的临床试验正在启动中。癌症疫苗曾被寄予厚望, 但目前成功用于治疗肺癌的疫苗临床报道很少。
在晚期肺癌的治疗中, 两种肺癌疫苗(VAXIRA和CIMAVAX)能使患者获益[1, 2], 而在STOP试验中, Belagenpumatucel-L疫苗治疗却未能增加晚期患者的DFS及总生存时间[3]。在肺癌的辅助治疗中, 目前尚无获得成功的肺癌疫苗。START研究表明, 针对MUC-1的BLP25疫苗治疗并不能为已接受放化疗的Ⅲ 期肺癌患者带来临床获益[4]。同样, 本研究中MAGE-A3疫苗未能明显延长Ⅰ B~Ⅲ A期NSCLC患者的DFS。阴性结果并不能表明MAGE-A3这一位点无法用于肿瘤的治疗, 这可能是由以下几点因素导致的。
首先, 获得阳性结果的两种肺癌疫苗的受试人群均为晚期肺癌患者, 而MAGE-A3疫苗却用于早期或中期的术后患者, 相对而言肿瘤负荷更小, 其免疫原性可能不足以引发足够的免疫反应。术后辅助治疗的策略一般建立在晚期肿瘤治疗的基础上, 基于晚期患者中治疗的成功经验, 准确筛选获益人群, 才能应用于术后辅助治疗, 正如EGFR-TKI进行了10余年的晚期肺癌研究后才逐渐应用于肺癌辅助治疗。
其次, 目前术后辅助治疗主要应用于Ⅱ ~Ⅲ A期患者中[5], 而本研究纳入了高达47%的Ⅰ B期患者, 这部分患者可能无法从辅助治疗中获益。这部分Ⅰ B期患者可能缩小了两组间的生存差异, 因此在后续研究中, 需要减少该部分患者的比例才能证实肺癌疫苗在NSCLC辅助治疗中的作用。
第三, 在入组的人群中, 93%的患者有吸烟史。有研究表明吸烟患者可在PD-1/PD-L1抑制剂治疗中获益[6], 但吸烟与肺癌免疫疫苗的相互作用现在仍不清楚, 其是否会影响相关抗原的表达也值得进一步研究[7], 吸烟可能导致的免疫状态改变可能也对试验结果产生影响[8], 在后续的相关研究中, 研究者应纳入更多比例的非吸烟患者以得出更加客观的结果。
最后, 肺癌疫苗用于肺癌辅助治疗的目的是消灭微转移病灶, 以降低复发率并改善生存期。但由于肿瘤的异质性, 即使能杀灭MAGE-A3高表达肿瘤细胞, 还会有MAGE-A3低表达肿瘤细胞残留, 因此难以完全消除潜在的复发转移。
虽然NSCLC疫苗的治疗效果在多数Ⅱ /Ⅲ 期临床试验中未能达到较为理想的状态, 但其治疗的安全性在诸多临床试验中得到了确认。尽管目前一些肺癌疫苗的疗效仍有待确认, 但随着研究的进一步深入, 疫苗很可能在NSCLC综合治疗中发挥重要作用。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|