2020年6月6日, 由中国临床肿瘤学会和中国抗癌协会肺癌专业委员会主办, 中国胸部肿瘤研究协作组、广东省抗癌协会肺癌专业委员会、广东省医学科学院、广东省人民医院和广东省肺癌研究所承办的第17届中国肺癌高峰论坛在线上召开。此次论坛对不可切除局部晚期/转移性非小细胞肺癌(non-small cell lung cancer, NSCLC)起始治疗展开学术探讨, 达成了专家共识。不可切除局部晚期和转移性NSCLC约占肺癌的50%~60%, 选择不同治疗方案的预后不同[1, 2]。精准治疗时代的来临, 靶向治疗与免疫治疗已经成为除传统放化疗之外不可切除局部晚期/转移性NSCLC起始治疗的有力武器, 但仍然存在理想生物标志物的选择、治疗方案的科学组合、是否区分靶点的不同亚型及脑转移、不同免疫药物的选择、单药还是联合用药以及安全性等诸多问题。本次论坛结合我国不可切除局部晚期/转移性NSCLC起始治疗的状况, 围绕驱动基因、生物标志物、疗效评价指标和随访等问题开展了深入研讨和交流, 最终达成了以下九点专家共识。
本共识的共识级别为:
1A级:基于高水平证据(严谨的Meta分析或 RCT结果), 专家组有统一认识;
1B级:基于高水平证据(严谨的Meta分析或 RCT结果), 专家组有小争议;
2A级:基于低水平证据, 专家组有统一认识;
2B级:基于低水平证据, 专家组无统一认识, 但争议不大;
3级:专家组存在较大争议。
共识一:随着越来越多肺癌驱动基因的发现和相应特异治疗药物的上市, 推荐采用高通量的检测方法一次性发现可靶向的驱动基因并一线使用相应的靶向药物治疗
共识级别:1A。
2020年5月美国食品药品监督管理局(Food and Drug Administration, FDA)批准布加替尼(brigatinib)用于经FDA批准的试剂检测的ALK阳性转移性NSCLC的一线治疗, 该批准基于ALTA-1L临床试验结果, 该结果比较了brigatinib与克唑替尼在未接受ALK抑制剂治疗的ALK阳性局部晚期或转移性NSCLC患者中的疗效与安全性。经过2年以上随访, brigatinib表现出优于克唑替尼的抗肿瘤活性, 尤其是在基线脑转移患者中, 具有显著的抗肿瘤活性[3]。
2018年11月劳拉替尼(lorlatinib)获美国FDA批准用于治疗克唑替尼治疗进展后或至少一种ALK抑制剂治疗后进展的NSCLC。劳拉替尼是新一代的ALK抑制剂, 其疗效在B7461001多中心Ⅰ /Ⅱ 期临床试验中得到证实, 总缓解率达到48%, 其中69%的患者伴随脑转移而颅内缓解率也达到60%[4, 5]。
恩曲替尼(entrectinib)也是新近获批的一个明星药物。恩曲替尼是一种新型、口服、具有中枢神经系统活性、针对NTRK1/2/3、ROS1或ALK基因融合, 具有较高血脑屏障透过率的酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)。恩曲替尼是泛癌种药物, 非针对某一种特定的癌症类型, 而是针对具有NTRK、ROS1或ALK基因融合的肿瘤患者, 通过和这三种基因编码的蛋白, 分别是NTRK、ROS1以及ALK蛋白结合从而达到抑制肿瘤的目的。其中恩曲替尼在ROS1融合的肿瘤患者中的客观缓解率(objective response rate, ORR)达到77%[6], 而在NTRK融合的肿瘤患者中的ORR也达到57%[7]。
对于另外一个靶点BRAF V600E, 美国FDA批准达拉非尼(dabrafenib)+曲美替尼(trametinib)双药联合治疗BRAF V600E阳性的NSCLC患者, 因为双药联合的总体缓解率高达67%, 远远超过了单药治疗的缓解率33%[8, 9]。
2020年2月, 卡马替尼(capmatinib/INC280)获得美国FDA优先审批资格, 这是因为Geometry mono-1研究中MET外显子14跳跃突变的NSCLC中卡马替尼疗效显著。其中初治患者的ORR达67.9%, 而既往接受过化疗的患者ORR也高达40.6%[10]。同时日本基于VISION研究中接受tepotinib治疗的患者ORR达到42.4%, 因此批准tepotinib用于治疗不可切除MET外显子14跳跃突变的NSCLC[11]。
近日在《Lancet Respir Med》发表的吴一龙教授领衔的INSIGHT研究中, 对于EGFR-TKI耐药后出现cMET扩增(拷贝数≥ 5或MET/CEP7≥ 2)的NSCLC患者, 使用吉非替尼联合tepotinib, 中位无进展生存期(median progression-free survival, mPFS)为16.6个月, 中位总生存期(median overall survival, mOS)长达37.3个月, 远高于化疗组的4.2个月(mPFS)和13.1个月(mOS)。在免疫组化强阳性(IHC 3+)患者中, 双靶向治疗组的mPFS和mOS分别为8.3个月和37.3个月, 同样高于化疗组的4.4个月和17.9个月。更有意思的发现是, 可先用免疫组化这种简单便宜的方法进行初筛, 而后用荧光原位杂交(fluorescence in situ hybridization, FISH)来进一步确认合适的患者[12]。
RET是一个原癌基因, RET突变广泛存在于各大癌种中, 但既往并无FDA批准的高选择性RET靶向抑制剂。而LOXO-292, 作为新近批准的高选择性RET抑制剂, 可以精准抑制RET蛋白信号, 同时毒副作用更小, RET融合阳性NSCLC的ORR达77%[13]。而另一个高选择性RET靶向抑制剂BLU-667也即将上市。
通过以上多个靶点可以看到NSCLC跟其它实体肿瘤的不同在于它演示了什么是精准医学。精准医学, 即通过基因的突变异常来选择靶点进行治疗。综上, 至少有7个靶点需要检测, 而如果像过去进行单个检测则会耽误大量时间。基于此, 专家组认为:随着越来越多肺癌驱动基因的发现和相应特异治疗药物的上市, 推荐采用高通量的检测方法一次性发现可靶向的驱动基因并一线使用相应的靶向药物治疗。
共识二:随着同一情况下可选择的药物和方法越来越多, 需要建立一个兼顾疗效、安全性、生存质量和补偿机制的综合评分系统, 以让患者得到较为理想的治疗价值
共识级别:2B。
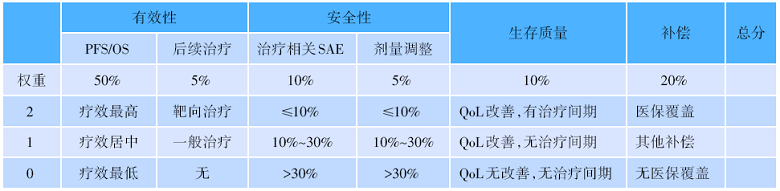
精准治疗时期, 我们的武器越来越多, 因此对于临床方案的选择造成一定的挑战。在此次论坛上, 专家们首次提出了“ 中国肺癌治疗价值评分系统” 。该系统从药物疗效、安全性、生存质量和补偿机制等四个方面进行综合评分, 使得患者获得较为理想的治疗的价值。治疗价值是由美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)在2016年率先提出, 即患者从治疗中获益与付出的费用处在一个合理的水平, 而这个合理水平也就是我们通常讲的效能— — 肿瘤价值的核心。欧洲肿瘤内科学会(European Society for Medical Oncology, ESMO)、ASCO、美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)分别制定了肿瘤治疗的价值[14, 15, 16]。而在这三个价值里面, 共同的特点就是把现在临床上可考虑的因素用复杂的算法结合。因此结合中国国情我们提出来一个中国胸部肿瘤系统的评分系统— — 有效性、安全性、生存质量、补偿机制结合, 通过这个系统来确定各个药物的先后使用顺序, 从而为患者制定合适的治疗方案, 得到理想的治疗价值, 见表1。
| 表1 肺癌治疗价值CTONG评分 |
有效性:包括PFS/OS和后续治疗。以OS为主, 取得统计学意义且相差2个月以上; 不同级别PFS差异必须是相差3个月以上; 后续治疗:如果有biomarker指导的明确靶点的治疗为靶向治疗; 只有化疗的为一般治疗; 没有标准治疗的为无; 治疗间期:存在无需治疗时间(treatment holiday)。SAE:严重不良事件; QoL:生存质量
共识三:需要细分EGFR敏感突变的两个亚型(exon19和exon21 L858R)和是否伴有脑转移, 分别给与不同的治疗
• 对于exon19缺失, 优先推荐奥希替尼或阿法替尼;
• 对于exon21 L858R突变, 优先推荐达可替尼、厄洛替尼+贝伐珠单抗或埃克替尼;
• 对于脑转移患者, 优先推荐奥希替尼、埃克替尼
共识级别:1B。
EGFR突变的发现开启了精准治疗时代, 而在19外显子缺失突变(19del)和21外显子点突变(21 L858R)两种亚型中患者的临床病理特征和对EGFR-TKI的治疗疗效也有所差异。多个大型的随机对照试验(randomized controlled trial, RCT)中看到第一代、第二代和第三代EGFR-TKI治疗19del和21 L858R突变患者显示出不同的疗效, 总体来看, 19del突变患者的PFS和OS获益要明显高于21 L858R突变的患者[17, 18, 19, 20, 21, 22, 23, 24]。
目前针对EGFR突变患者, 联合用药是较为常见的治疗方案。在NEJ026和CTONG1509中, 使用厄洛替尼联合贝伐珠单抗在21 L858R患者中获益优于19del的患者[25]。因此综合评分系统将患者分为19del、21 L858R与伴随脑转移, 在19del患者中奥希替尼与阿法替尼的总生存有统计学意义的, 因此优先推荐。而对于exon21 L858R突变, 优先推荐达可替尼、厄洛替尼+贝伐珠单抗或埃克替尼。对于脑转移患者, 优先推荐奥希替尼、埃克替尼。
共识四:对于ALK融合的晚期非小细胞肺癌, 推荐阿来替尼为初次治疗的首选药物
共识级别:1A。
克唑替尼、塞瑞替尼(ceritinib)和阿来替尼(alectinib)作为获批一线治疗ALK融合晚期NSCLC的药物, 在2020年ASCO报道中, 阿来替尼还未达到mOS而对照组克唑替尼的mOS为57个月, 因此阿来替尼将成为历史上第一个会突破5年中位生存的ALK抑制剂。因此对于ALK阳性的患者, 根据评分系统计算推荐在一线使用阿来替尼。
共识五:基于综合评分系统评分, 对于驱动基因阴性, PD-L1> 50%的晚期非小细胞肺癌患者, 首次治疗优先推荐pembrolizumab单药治疗, 也可考虑pembrolizumab联合化疗
共识六:不论PD-L1表达如何, 对于驱动基因阴性的晚期非小细胞肺癌, 首次治疗优先推荐pembrolizumab联合化疗
共识级别:1B。
IMpower110研究结果显示, 对于程序性死亡配体1(programmed death ligand 1, PD-L1)高表达[肿瘤细胞(tumor cell, TC)≥ 50%或免疫细胞(immune cell, IC)≥ 10%]的NSCLC患者, 与含铂化疗相比, atezolizumab可明显改善总生存(mOS:20.2m vs. 13.1m, P=0.010 6)[26]。基于此, 2020年5月, 美国FDA批准atezolizumab单药用于一线治疗PD-L1高表达(TC≥ 50%或IC≥ 10%)的EGFR/ALK阴性局部晚期或转移性NSCLC患者。这一结果, 同KEYNOTE-042研究有异曲同工之效。KEYNOTE-042中, 同标准化疗方案相比, pembrolizumab单药能显著延长PD-L1阳性肿瘤比例得分(tumor proportion score, TPS)≥ 1%的局部晚期或转移性NSCLC初治患者的总生存[27]。将KEYNOTE-042同IMpower110、CheckMate-227、KEYNOTE-189、KEYNOTE-407进行对比, 综合评估有效性(mOS、mPFS)和安全性(不良反应、药物中断), 无论是在PD-L1> 50%还是在PD-L1> 1%的患者中, KEYNOTE-042均具有mPFS/mOS同其他研究接近但副作用低的优势。
而在不考虑PD-L1表达水平的非鳞肺癌或者晚期肺癌免疫治疗相关研究中, Reck教授[28]领导的CheckMate-9LA研究可谓一项创新设计。研究者尝试早期利用化疗解决免疫治疗起效慢的问题, 使用双免疫治疗(nivolumab+ipilimumab)联合化疗(2周期), 用于一线治疗EGFR/ALK阴性的晚期NSCLC患者。今年ASCO上公布了这项研究的OS, 为15.6个月, 3~4级不良反应达到47%, 结果似乎不太理想, 但减少化疗的设计仍令人印象深刻。
因而在中国, 考虑到药物的可及性及治疗方案的从简性, 基于KEYNOTE-189(非鳞NSCLC中pembrolizumab联合化疗)和KEYNOTE-407(鳞癌中pembrolizumab联合化疗)的研究结果, 专家组认为, 在综合治疗的评价系统的基础上, 对于PD-L1> 50%的驱动基因阴性的晚期NSCLC, 首先推荐pembrolizumab单药治疗, 同时也可考虑pembrolizumab联合化疗。或者, 不考虑PD-L1表达水平, 对于驱动基因阴性的晚期NSCLC, 首次治疗优先推荐pembrolizumab联合化疗。
共识七:不可手术局部晚期非小细胞肺癌, 优先推荐同期化放疗后durvalumab巩固维持治疗
共识八:Ⅳ 期小细胞肺癌, 首次治疗优先推荐PD-L1抑制剂联合EP方案化疗
共识级别:1A。
PACIFIC研究[29]中, 针对不可手术的Ⅲ 期NSCLC患者, 在标准同步放化疗后, 使用durvalumab进行维持治疗, 使患者的OS、PFS、至死亡或远处转移时间(time to death or distant metastasis, TTDM)均明显提高, 同安慰剂对比, 3年总生存率从43%提高到57%, 明显获益, 改变了不可切除的局部晚期NSCLC的治疗格局。
而对于Ⅳ 期小细胞肺癌(small cell lung cancer, SCLC), IMpower133[30]对比了标准EP化疗联合或不联合atezolizumab的疗效和安全性。研究显示, 联合组的中位PFS和OS均优于单纯化疗组。2019年3月, 美国FDA批准atezolizumab联合化疗用于一线治疗Ⅳ 期SCLC。2020年2月, 中国国家药品监督管理局批准该项适应证。相比于IMpower133, 另外一项免疫抑制剂联合化疗的CASPIAN研究[31]设计则更贴近中国临床。CASPIAN中, durvalumab联合EP方案可持续为Ⅳ 期SCLC患者带来总生存的获益, 24个月总生存率提高至22.2%, 所有预设的亚组分析均可观察到免疫联合化疗的优势。研究还另外设置了一组durvalumab及tremelimumab联合EP的方案, 同durvalumab联合EP相比, 双免疫联合化疗并无法达到更好的疗效, 似乎是一个画蛇添足的效果。而2020年ASCO年会上, 公布了两项新的临床试验, ECOG-ACRIN EA5161[32]和KEYNOTE-604[33]。ECOG-ACRIN EA5161是一项随机对照Ⅱ 期临床试验, 在Ⅳ 期SCLC初治患者中, 对比标准化疗联合或不联合nivolumab的疗效和安全性。两组的mPFS分别为5.5个月(EP+nivolumab)和4.6个月(EP)[风险比(hazard ratio, HR)=0.65, 95%可信区间(confidence interval, CI)0.46~0.91, P=0.012], mOS分别为11.3个月(EP+nivolumab)和8.5个月(EP)(HR=0.67, 95%CI 0.46~0.98, P=0.038)。KEYNOTE-604研究中, 对于Ⅳ 期SCLC初治患者, 对比标准化疗联合或不联合pembrolizumab的疗效和安全性。研究结果显示, 虽然标准EP方案联合pembrolizumab可延长PFS, 但在OS方面, 尽管有延长趋势, 但并未达到研究预设阈值。
因而, 对于不可手术局部晚期NSCLC, 优先推荐同期化放疗, 用durvalumab进行巩固维持治疗。对于Ⅳ 期SCLC, 首先推荐PD-L1抑制剂联合EP的方案。值得注意的是, 基于上述的研究结果, 我们可得出, PD-1抑制剂, 包括pembrolizumab和nivolumab, 在SCLC中前景不佳, 专家组认为, 未来SCLC的治疗, 可能是PD-L1的天下。
共识九:在综合评分的基础上, 仍需结合每一位患者的具体情况如PS状态选择最适合的治疗方案进行精细化管理
共识级别:2B。
在强调个体化精准治疗的今天, 仅靠共识二中的评分系统选择临床治疗方案, 是不充分的, 需要在综合评分的基础上, 结合每位患者的具体情况(比如PS评分、进行过器官移植、患有自身免疫性疾病等)做出正确评估, 选择最好的治疗方案, 给与精细化管理。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|