作者简介:
廖惠钰(1993-),女,广东佛山人,医学硕士,主要研究方向为急性髓系白血病。
目的 探讨克拉屈滨联合阿糖胞苷和拓扑替康(CLAT)方案联合供者粒细胞集落刺激因子动员的外周血单个核细胞(微移植,G-PBSC)治疗难治性急性髓系白血病(acute myeloid leukemia,AML)的有效性及安全性。方法 广东省人民医院血液科2015年4月至2018年11月接受CLAT方案联合供者G-PBSC治疗难治性AML患者。CLAT方案:克拉屈滨5 mg/m2/d,静脉滴注,d1~d5;阿糖胞苷1 mg/m2/d,静脉滴注,d1~d5;拓扑替康1.25 mg/m2/d,口服,d1~d5;粒细胞集落刺激因子300μg/d,d6至中性粒细胞计数>1.0×109/L。目标剂量为单个核细胞2.0×108/kg或CD3+细胞1.0×108/kg。结果 9例患者中位年龄34岁(范围:20~44岁);男性7例,女性2例,5例为原发难治性AML患者,4例为继发难治性AML患者。第一疗程疗4例(44.4%)患者获得完全缓解,3例(33.3%)患者获得部分缓解,总反应率为77.8%,累计完全缓解率为55.6%。9例患者均于微移植治疗后出现Ⅳ度骨髓抑制,中性粒细胞计数<0.5×109/L持续中位时间为14(7~21)天,血小板计数<20×109/L持续中位时间为8(0~19)天。结论 CLAT方案联合供者粒细胞集落刺激因子动员后的外周血造血干细胞治疗难治性AML反应率高,不良反应可控。
Objective To investigate the efficacy and safety of cladribine combined with cytarabine and topotecan (CLAT) regimen combined with granulocyte colony-stimulating factor(G-CSF)-mobilized donor peripheral blood stem cell(G-PBSC) in the treatment of refractory acute myeloid leukemia (AML).Methods We analyzed refractory AML patients receiving programmed infusions of G-PBSC after the CLAT regimen of chemotherapy treatment. A total of 9 patients with refractory AML (median age 34 years, range 20 to 44 years, male n=7, female n=2) were treated with CLAT regimen which consisted of cladribine 5 mg/m2/d intravenously for 5 consecutive days (day 1~5) and topotecan 1.25 mg/m2/d in oral for 5 days(day 1~5) for priming combined with cytarabine of 1.5 g/m2/d q12h intravenously for 5 days (day 1~5). G-CSF of 300 μg/day subcutaneous injection on day 6 until neutrophil granulocyte count was ≥1.0×109/L. Donor stem cells were transfused into the patient at CD3+ cell 1.0×108/kg.Results Nine patients underwent at least one cycle of microtransplantation. After the first cycle, four patients (44.4%) achieved a complete remission (CR) and 3 patients (33.3%) achieved partial remission (PR), the overall response rate was 77.8%. Five patients had a CR rate of 55.6% after the second cycle. The median recovery time for neutrophils and platelets was 14(7~21) days and 8(0~19) days.Conclusion CLAT regimen in combination with microtransplantation was well tolerated and showed a promising clinic efficacy in patients with refractory AML.
急性髓系白血病(acute myeloid leukemia, AML)是成年人最常见的急性白血病。目前的治疗以化疗为主[1]。针对难治性AML(refractory-AML, R-AML)的再诱导缓解治疗, 国际上各治疗方案疗效差异大, 尚无统一标准的治疗方案。R-AML预后差[1, 2], 目前无标准挽救化疗方案。微移植是指在一定强度化疗的基础上, 联合供者粒细胞集落刺激因子(granulocyte colony-stimulating factor, G-CSF)动员后的外周血造血干细胞(G-CSF mobilized donor peripheral blood stem cell, G-PBSC)输注的新兴疗法。近年来, 微移植治疗技术为AML患者提供了一种安全、有效的治疗方法。我们应用克拉屈滨联合阿糖胞苷和拓扑替康(CLAT)方案联合G-PBSC(微移植)治疗9例R-AML患者获得较好的疗效, 现报告如下, 并进行相关文献复习。
2015年4月至2018年11月于广东省人民医院血液科诊断为R-AML的患者。入选标准:(1)符合R-AML诊断标准[3, 4, 5], 满足以下任一条件:①标准方案诱导1个疗程未获得完全缓解(complete response, CR)/CR伴血细胞计数不完全缓解(incomplete blood count recovery, CRi), ②获得CR1后6个月内复发(早期复发), ③获得CR1后6个月后复发(晚期复发)且经再诱导失败, ④2次或以上复发, ⑤髓外白血病持续存在, ⑥在巩固治疗过程中复发; (2)年龄≥ 14岁; (3)ECOG评分≥ 3; (4)具有供者; (5)签署知情同意书。
1.2.1 预处理方案
1.2.1.1 CLAT方案 克拉屈滨(cladribine, Cla) 5 mg/m2/d, 静脉滴注, d1~d5; 阿糖胞苷(cytarabine, Ara-C) 1.0 mg/m2/d, 静脉滴注, d1~d5; 拓扑替康(topotecan, Top) 1.25 mg/m2/d, 口服, d1~d5; 粒细胞集落刺激因子(granulocyte colony-stimulating factor, G-CSF)300 μ g/d, d6至中性粒细胞计数(absolute neutrophil count, ANC)> 1.0× 109/L。
1.2.1.2 诱导缓解后治疗方案 获得部分缓解(partial remission, PR)或CR的患者可继续接受1~2个疗程CLAT方案化疗联合粒细胞集落刺激因子动员的供者外周血干细胞 (G-CSF-mobilized donor peripheral-blood stem cells, G-PBSC)治疗。未能获得缓解(not response, NR)者退出研究。获得CR患者后续可接受异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation, allo-HSCT)或继续巩固维持治疗。
1.2.2 供者造血干细胞动员、采集及移植
G-PBSC健康供者签署捐赠同意书, 接受G-CSF 10 μ g/kg/d分2次皮下注射, 动员, 于d5、d6, 采用COBE-spectra6.0血细胞分离仪采集外周血干细胞(peripheral-blood stem cells, PBSC)。PBSC采集后, 根据预定目标治疗剂量1.0± 0.3× 108/kg分装、冻存于液氮罐中。患者停止化疗后24~72 h, 接受目标剂量为含单个核细胞2.0× 108/kg/次或CD3+细胞1.0× 108/kg/次的G-PBSC细胞输注。
1.3.1 疗效标准
参照2003年Cheson国际协作组关于AML诊断、治疗反应标准的修订报告[3]。
1.3.2 定义
缓解率(R = CR+CRi), 总反应率(OR=CR+CRi+PR); 总生存期(overall survival, OS):为从患者接受微移植起至死亡或末次随访时间止; 无病生存期(disease free survival, DFS):从患者获得CR/CRi时间起至复发、死亡或末次随访时间止。对于疾病恶化而放弃治疗的患者, 生存期以最近一次随访时间为准。诱导化疗开始至化疗后30天内发生的死亡事件为早期死亡。随访截止日期为2018年11月。
1.4.1 观察指标
中性粒细胞、血小板恢复时间, 感染发生率及严重程度, 心脏不良反应的发生率、严重程度及持续时间, 及其他不良反应的发生率和严重程度。
1.4.2 评估标准
治疗相关不良反应评估根据国际肿瘤化疗药物不良反应评价系统通过不良事件常见术语标准4.0版(common terminology criteria, CTCAE v4.0)进行评估。
所有接受微移植治疗的患者于诱导治疗前、诱导治疗第28天± 7天、每次治疗前、结束治疗后至满3年每3个月进行疗效评估。接受治疗第1天至接受新一疗程治疗的前1天, 或至治疗结束后第28天进行安全性评估。
定量指标应用中位值进行描述; 分类指标采用频数、率、构成比进行描述; 采用Fisher确切概率检验进行差异性检验, 所有检验均采用双侧检验。OS和DFS采用Kapplan-Meier方法进行分析。应用SPSS 20.0统计软件进行统计分析。
2015年4月至2018年11月入组9例R-AML患者, 男性7例, 女性2例, 中位年龄34(20~44)岁。疾病分型(FAB分类):M2 4例, M4 3例, 未分类2例。其中5例为“ 3+7” 诱导治疗失败的R-AML患者(1个疗程2例, 2个疗程3例), 4例为继发R-AML患者。染色体核型危险度分型:低危1例、中危8例。根据EPI预后分层标准[6](根据指标评分:第一次CR持续时间、第一次复发年龄、第一次复发前是否接受移植):预后较好(1~6分, 1年总生存率为70%)1例, 预后中(7~9分, 1年总生存率为49%)1例, 预后差(10~14分, 1年总生存率为16%)7例。患者微移植前接受化疗中位次数为2.5个疗程(1~8个疗程); CR1中位持续时间为2.05个月(0~9.2个月)。9例患者接受14例次CLAT+G-PBSC治疗。
供者情况:9例供者, 男性7例, 女性2例, 中位年龄23(18~52)岁。供受者为亲缘关系4例:分别为兄妹、表兄弟、表兄妹和爷孙关系; 非血缘关系5例。女供男2例, 男供女2例, 余为供受同性别。回输单个核细胞(mononuclear cell, MNC)中位值为2.36(1.9~4.02)× 108/kg, CD3+细胞中位值1.03(0.65~1.32)× 108/kg, CD34+细胞中位值4.41(1.9~5.8)× 106/kg。
所有患者完成第一个疗程的CLAT联合G-PBSC治疗, 其中4例(44.4%)患者获得CR, 3例(33.3%)患者获得PR, 2例NR, 总反应率为77.8%。9例患者共完成14个疗程CLAT联合G-PBSC治疗。2例PR患者接受原方案再次诱导, 1例获得CR, 1例仍为NR, 2个疗程微移植累计完全缓解率为55.6%(5/9)。5例标准“ 3+7” 诱导失败的R-AML患者中4例(80.0%)获CR, 1例NR; 4例继发性R-AML中1例(25%)获得CR。EPI评分预后差的7例患者中, 4例(57.1%)获得CR, 1例预后中等患者获得PR, 1例预后好患者为NR。
2.3.1 血液学不良反应
9例患者均发现Ⅳ 级骨髓抑制(100%):ANC< 0.5× 109/L发生率为100%, 中位持续时间为14(7~21)天; 血小板计数(Platelet, PLT)< 20× 109/L发生率为88.9%, 中位持续时间为8(0~19)天。浓缩红细胞输注中位值为2(0~5)U, 其中1例患者无需血小板输注治疗。所有患者均发生不同程度的感染, 8例患者发生了13例次Ⅲ ~Ⅳ 级感染:其中败血症3例次(33.3%), 肺部感染7例次(77.8%)(其中3例为微移植治疗前已存在肺部感染), 消化道感染2例次(22.2%), 肛周粘膜感染1例次(11.1%)。1例获得CR患者于再次巩固治疗后第45天因肺曲霉菌感染死亡, 另1例CR患者在接受第3疗程巩固时, 因合并重症肺炎死亡, 其余患者的感染均能得到有效控制。
2.3.2 非血液学不良反应
CLAT联合G-PBSC方案主要发生Ⅰ ~Ⅱ 度非血液学不良反应:3例(22.2%)发生Ⅱ 度胃肠道反应:恶性、呕吐各1例, 腹泻1例; Ⅱ 度口腔黏膜炎1例, 对症治疗获得缓解。Ⅰ 度转氨酶或胆红素升高3例, Ⅰ 度肌酐升高1例, Ⅰ 度头晕1例, Ⅰ 度头痛1例。Ⅲ 度皮疹2例(22.2%), 其中1例患者在CLAT化疗第5天出现皮疹, 在激素治疗后2天皮疹消退, 输注G-PBSC后未出现皮疹; 1例患者在G-PBSC输注后2天出现四肢皮肤弥漫红疹伴有瘙痒, 激素治疗后缓解。临床未发现患者出现移植物抗宿主病(graft-versus-host disease, GVHD)及心脏毒性。
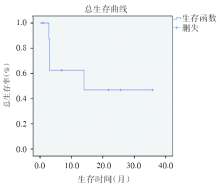
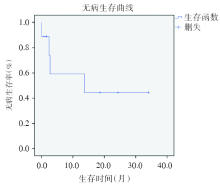
2015年4月1日至2018年11月26日, 中位随访时间6.9(1~35.8)个月。9例患者中, 4例接受allo-HSCT(CR 2例, NR 2例), 其中3例患者DFS分别为:21.8、25.7、35.8个月。该组病例1年预期总生存率为46.9%, 预期平均OS为20.1± 5.5个月[95%可信区间(confidence interval, CI) 9.2~30.9]; 1年预期无病生存率为44.4%, 预期平均DFS为18.0± 5.6个月(95%CI 6.9~29.0)。总生存曲线见图1, DFS曲线见图2。EPI评分预后差(10~14分, 1年总生存率为16%)的患者1年预期总生存率为44.4%, 1年预期无病生存率为40.0%, EPI评分好及良好组因病例数少未进行评估。至末次随访, 3例患者存活, 死亡6例, 3例死于AML; 1例CR患者于allo-HSCT后283天因脑出血死亡; 另外2例分别在第2或第3次巩固治疗后因感染死亡。在9例患者中, 第1疗程微移植治疗相关死亡率为0%。
AML在以蒽环类药物联合标准剂量阿糖胞苷的“ 3+7” 方案的标准诱导治疗下, 完全缓解率可达60%~80%, 但有20%~30%的初诊AML患者不能获得CR(原发耐药AML), 即使获得CR1的患者复发率仍高达50%, 仅约30%的患者可以获得较长的无病生存, R-AML预后差、生存期短[1]。
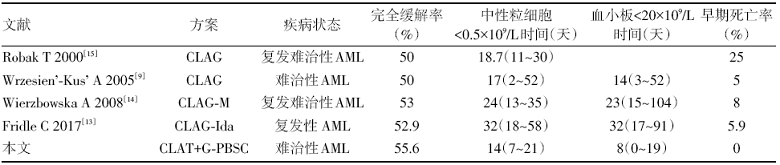
Allo-HSCT仍然是根治复发/难治AML的方法, 而移植前缓解状态是影响造血干细胞移植疗效的关键独立因素。目前R-AML的拯救性治疗仍以大剂量阿糖胞苷联合蒽环/蒽醌类药物为基础方案。近年来国内外指南推荐拯救方案有CLAG± M/I方案、MAE、FLAG± I, Ara-C+蒽环/蒽醌类药物或联合靶向治疗, 对R-AML的再诱导缓解率约为40%~60%[7, 8, 9, 10, 11, 12, 13, 14]。不含蒽环/蒽醌类药物的CLAG或FLAG方案治疗R-AML的完全缓解率仅25.9%~50%[9, 10, 12, 15], 而含蒽环/蒽醌类药物的治疗方案的完全缓解率约50%~58%[7, 13]。但早期诱导死亡率为5%~25%[9, 13, 14, 15], 而且R-AML患者既往多已使用过蒽环/蒽醌类药物, 可能已经存在对蒽环/蒽醌类药物耐药, 或蒽环/蒽醌类药物已接近终生累积量, 再次使用此类药物将增加心脏毒性的风险[16]。
CLAT方案在CLAG的基础上引入拓扑替康。众所周知:克拉屈滨为新型核苷类似物, 主要以被动转运进入细胞内后被脱氧胞苷激酶磷酸化, 转化为克拉屈滨三磷酸, 掺入到DNA中, 从而阻碍DNA断裂后的修复, 抑制核糖核苷酸还原酶, 干扰细胞代谢并导致线粒体损伤诱导凋亡, 发挥抗白血病作用; 克拉屈滨还可增加S期细胞脱氧胞苷酶(DKG)活性, 增加Ara-C转化为Ara-CTP, 使Ara-CTP积累速率增加了50%~65%[17], 增强Ara-CTP对白血病细胞的杀灭作用[18]。克拉屈滨引起DNA错配和DNA链终止, 诱导细胞内脱氧腺苷水平降低, 与阿糖胞苷具有协同杀肿瘤细胞作用[19]。而拓扑替康为拓扑异构酶Ⅰ 抑制剂, 可特异性与DNA单链断端上的拓扑异构酶结合, 阻断DNA合成及拓扑异构酶Ⅰ 的再循环利用, 阻止DNA单链断端的修复, 从而破坏DNA的双链结构, 发挥细胞毒作用[20, 21]。但拓扑替康单药治疗效果不佳, 需要长时间药物维持才能破坏拓扑异构酶Ⅰ 复杂的DNA修复机制, 患者往往不能耐受而出现严重的骨髓抑制; Inaba等[22]的体外研究发现克拉屈滨可增加拓扑替康对DNA修复的抑制作用。故此, 我们提出克拉屈滨联合拓扑替康的CLAT方案可增强抗肿瘤作用, 克服蒽环/蒽醌类药物的耐药及心脏毒性。本中心前期研究应用CLAT方案治疗18例R-AML患者获得66.7%的总反应率, 其中完全缓解率为55.6%[23], 但治疗相关死亡率为11.0%。微移植借助G-PBSC增加过继免疫治疗作用和促进骨髓造血恢复的作用, 显著提高老年AML缓解率(80%)、生存率(3年总生存率为39%)和缩短骨髓抑制期[24, 25]。
综合上文所述, 本中心开展了CLAT联合G-PBSC输注治疗R-AML的临床研究。初步结果显示CLAT+G-PBSC治疗R-AML的完全缓解率为55.6%, 与目前复发/难治性AML的拯救方案疗效相当[7, 8, 9, 10, 11, 12], 而且未发生首次诱导的早期死亡。有关复发/难治性AML治疗经验的文献报道中, 对比见表1, 常纳入复发患者(晚期、早期), 与晚期复发患者相比, 难治性和早期复发患者对化疗的反应和总体预后更差[26, 27, 28]。对于原发/难治性AML采用大剂量阿糖胞苷为主联合化疗或者CLAG-M方案获得的完全缓解率为10%~50.7%[14, 29], 本研究初步结果显示CLAT+G-PBSC治疗原发R-AML的完全缓解率达80%。CLAT+G-PBSC方案对于EPI预后差[6](10~14分, 1年总生存率为16%)的患者也获得较好的治疗效果, 1年预期总生存率达46.9%, 1年预期无病生存率达44.4%。在血液学不良反应方面, 本研究显示骨髓抑制时间较目前常用二线拯救方案缩短(ANC< 0.5× 109/L中位持续时间为14天 vs. 19~32天 ; PLT< 20× 109/L中位持续时间为8天vs. 22~32天)[7, 8, 13, 30]。供者G-CSF动员的外周血干细胞输注缩短了血小板、中性粒细胞的恢复时间, 促进造血恢复, 且没有发生急性或者慢性GVHD反应及移植相关并发症。CLAG-M、CLAG-IDA、CLAT方案的治疗复发/难治性AML早期死亡率为5%~11%[9, 13, 14, 23]。本研究未观察到治疗早期死亡, 输注G-PBSC不仅增强白血病细胞 (graft versus leukemia, GVL)效应, 同时缩短骨髓抑制时间, 降低治疗早期相关死亡率。
| 表1 用于治疗复发/难治性急性髓系白血病化疗方案的对比 |
微移植抗肿瘤作用的治疗机制并未研究清楚, 尚待进一步阐明。目前推测可能有以下机制参与发挥治疗作用:(1)G-PBSC含有供者造血干细胞和肿瘤杀伤特异细胞(如T淋巴细胞、自然杀伤细胞等)。肿瘤杀伤特异细胞介导细胞毒性作用, 输注的造血干细胞可在患者体内继续分化成熟, 部分植入患者体内长期存活, 供者淋巴细胞可持续清除残留的GVL, 提高治疗反应率。(2)供者粒细胞集落刺激因子动员的外周血干细胞分泌大量细胞因子, ①促进受者造血恢复, 缩短骨髓抑制期, 缩短血小板、中性粒细胞的恢复时间, 降低化疗相关并发症及死亡率, 减少血制品输注; ②促进受者免疫恢复, 增强受者抗白血病(recipient versus leukemia, RVL), 降低感染风险。(3)微移植在不损伤受者免疫功能的情况下, allo-G-PBSC供者移植物低水平植入< 1%[31, 32], 故极罕引发GVHD。(4)异源反应性的供者CD4+T淋巴细胞激活受者肿瘤特异性CD8+T淋巴细胞的抗肿瘤活性, 使无抗肿瘤活力的CD8+T淋巴细胞重新获得抗肿瘤能力[32], 激活异源效应可能是微移植抗肿瘤的重要机制[33]。
CLAT方案联合异基因G-PBSC(微移植)治疗R-AML初步结果显示对标准“ 3+7” 诱导失败、EPI预后差的患者可以获得更高的缓解率和低的早期诱导死亡率, 可以作为不宜使用蒽环类药物的取代方案, 为R-AML患者移植前桥接的挽救治疗方案。微移植发挥治疗作用的机制仍需进一步深入研究。本研究初步结果为进一步开展大样本的临床研究提供依据。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|